Kurzer Einblick in die klinischen Studien für die personalisierte Hautersatz-Therapie von CUTISS AG.
Der CEO von CUTISS AG, Dr. Daniela Marino erklärt die nächsten wichtigen Schritte für den jungen Start-up: die klinischen Studien
Das Dokument ist auch als PDF verfügbar: (ca. 326 kb):
Mit freundlicher Genehmigung der CUTISS AG, www.cutiss.swiss/de.
Die Haut ist bekanntermassen unser grösstes Organ. Sie besteht aus der äusseren Epidermis und der darunterliegenden Dermis. Sie ist unsere Schnittstelle zur Aussenwelt mit der wir fühlen sowie Kälte und Wärme empfinden. Sie ist unser Schutzschild und eine Barriere gegen Bakterien und Viren.
Wenn eine Hautverletzung sehr tief ist; also auch die Dermis betroffen ist, spricht man von einem Full-Thickness-Skin-Defect (FTSD) oder, auf Deutsch, einem Verlust der «Vollhaut». Die Verletzungen, die zu einem Verlust der Vollhaut führen können sind zum Beispiel Verbrennungen, Hautnekrosen und weitere tiefe Verletzungen. Momentan werden solche grossflächigen und tiefen Verletzungen standardmässig durch eine Eigenhauttransplantation mit Spalthaut (Split-Thickness-SkinGraft = STSG) gedeckt. Diese besteht aus Epidermis und einem kleinen Teil der Dermis.
Das Problem
Die oben beschriebenen Verletzungen führen oft zu Problemen, da die Dermis durch konventionelle Therapien nicht vollständig ersetzt werden kann und der Körper diese Lücke mit Narbengewebe auffüllt. Damit die Wunde schnellstmöglich geschlossen wird, zieht sich das Narbengewebe naturgemäss schnell zusammen. Bei Kindern ist das nicht nur ein kosmetisches Problem, sondern dieses Gewebe ist auch starr und wächst nicht mit. Nachfolgeoperationen werden nötig, um den Gelenken, bzw. generell Platz zum Wachsen zu ermöglichen. Daraus resultieren immer wiederkehrende Aufenthalte in Krankenhäusern und teilweise auch zusätzliche psychosoziale Rehabilitation und intensive Betreuung zu Hause. Ausserdem muss bei der Entnahme zur Eigenhauttransplantation vom Chirurgen eine weitere Wunde kreiert werden, was sehr unbefriedigend ist.
Unser Ansatz
denovoSkin™ ist ein personalisierter, bioengineerter dermo-epidermaler Hautersatz, der mehrere Probleme zu minimieren versucht, konkret durch die Deckung der Verletzung mit Epidermis und Dermis. Damit hoffen wir die Narbenbildung minimieren zu können und dass die Narbe besser mitwachsen sollte. Mit diesem Verfahren erhoffen wir, Nachfolgeoperationen minimieren zu können. Auch die Vermeidung einer zweiten grossen Wunde für die Spalthautentnahme wäre für den Patienten ein Vorteil.

denovoSkin™ ist ein sog. «Advances Therapy Medicinal Product» (ATMP), welches an der Universität Zürich zusammen mit dem Kinderspital Zürich entwickelt wurde. Dem Patienten wird eine kleine Hautbiopsie von etwa der Grösse einer Briefmarke entnommen, und daraus werden die Zellen von der Epidermis und der Dermis isoliert. Im Anschluss werden die Zellen separat voneinander vermehrt und danach wieder zu einem Hauttransplantat zusammengesetzt.
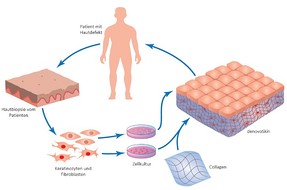
Da das Transplantat aus Eigenzellen besteht, ist eine Abstossungsreaktion sehr unwahrscheinlich. Momentan besteht der Herstellungsprozess hauptsächlich aus Handarbeit, aber alle Mitarbeiter in unserem Entwicklungslabor arbeiten mit Hochdruck an der Automatisierung des Herstellungsprozesses. Diese Automatisierung wird durch einen H2020 SME Instrument Grant der Europäischen Union unterstützt (http://CUTISS.swiss/h2020-sme).
Das Endziel ist es, dass denovoSkin™ der erste autologe Hautersatz ist, der alle Patienten sicher und effektiv behandeln kann.
Klinische Studien
denovoSkin™ hat die sog. «Orphan Drug Designation» für die Behandlung von Verbrennungen von der Swissmedic, der EMA und der FDA erhalten. Nach dem erfolgreichen Abschluss der ersten Phase der klinischen Studie laufen jetzt die Phase II Studien, in welchen die Wirksamkeit gegenüber der momentanen Behandlungsmethode untersucht wird. Momentan werden Patienten in den folgenden Zentren rekrutiert:
- Kinderspital Zürich, Schweiz
- Universitätsspital Zürich, Schweiz
- VUMedical Center, Amsterdam, Niederlande
- Dutch Burn Center, Beverwijk, Niederlande
In all diesen Zentren steht ein exzellentes Team aus erfahrenen Chirurgen zur Stelle, um die Patienten effektiv mit den bestehenden Standards zu behandeln, sowie denovoSkin™ im Rahmen der klinischen Studien anzuwenden. Weitere Zentren in sind auf dem Weg, hoffentlich ebenfalls bald Patienten mit denovoSkin™ behandeln zu können.
Wir rekrutieren momentan pädiatrische und erwachsene Patienten mit akuten Verbrennungen oder mit anderen Hauterkrankungen, die eine Hautverpflanzung nötig machen. Das können zum Beispiel Narbenkorrekturen, grosse Nävi, oder gutartige Tumore sein.
Es erfordert eine exzellente Zusammenarbeit von Patienten, CUTISS AG, der Universität Zürich, Chirurgen, Wissenschaftlern, Investoren und Patientenvereinigungen, um unsere innovative Therapie voranzubringen und hoffentlich in Zukunft allen Patienten zugänglich zu machen. Mehr Informationen unter: cutiss.swiss/de/....
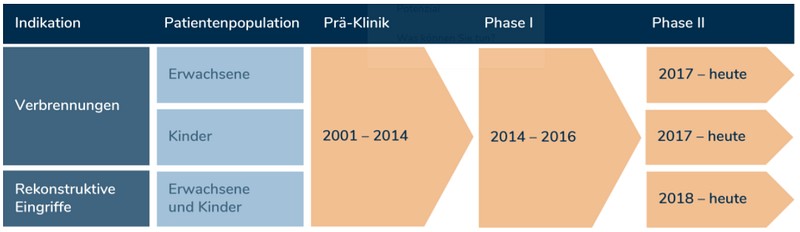
Studie 1: denovoSkin™ für Verbrennungen bei Erwachsenen
Titel:
Eine prospektive, intrapatient randomisierte, kontrollierte, multizentrische Phase-IIb-Studie zur Bewertung der Sicherheit und Wirksamkeit eines autologen biotechnologisch hergestellten dermo-epidermalen Hautersatzes (EHSG-KF) zur Behandlung von partiell tiefen und Vollhaut-Verbrennungen bei Erwachsenen im Vergleich zu autologen Spalthauttransplantaten (STSG).
Zusammenfassung:
Die Studie untersucht und vergleicht die Sicherheit und Wirksamkeit eines Hautersatzproduktes (denovoSkin™) aus patienteneigenen Zellen mit der aktuellen Standardmethode, d.h. der Transplantation eines dünnen autologen Hauttransplantats (Spalthauttransplantat), bei Patienten, die aufgrund einer Hautverbrennung ein Hauttransplantat benötigen.
Allgemeine Informationen:
Diese Studie wird bei Personen ab 18 Jahren durchgeführt, die aufgrund einer Hautverbrennung eine Hauttransplantation benötigen. Zwei verbrannte Hautbereiche werden ausgewählt und basierend auf einer zufälligen Verteilung wird das eine Areal mit denovoSkin™ und das andere mit Spalthaut des Patienten behandelt. Bei den Visiten nach der Transplantation werden beide Transplantate auf ihre Sicherheit und Wirksamkeit überprüft. Die gesamte Studie dauert etwa 12 Monate pro Patient und beinhaltet 10 Studienvisiten. Darüber hinaus finden jährliche Kontrollbesuche 2 und 3 Jahre nach der Transplantation statt.
Studie 2: denovoSkin™ für Verbrennungen bei Kindern
Titel:
Eine prospektive, intrapatient randomisierte, kontrollierte, multizentrische Phase-IIb-Studie zur Bewertung der Sicherheit und Wirksamkeit eines autologen biotechnologisch hergestellten dermo-epidermalen Hautersatzes (EHSG-KF) zur Behandlung von partiell tiefen und Vollhaut-Verbrennungen bei Kindern im Vergleich zu autologen Spalthauttransplantaten (STSG).
Zusammenfassung:
Die Studie untersucht und vergleicht die Sicherheit und Wirksamkeit eines Hautersatzproduktes (denovoSkin™) aus patienteneigenen Zellen mit der aktuellen Standardmethode, d.h. der Transplantation eines dünnen autologen Hauttransplantats (Spalthauttransplantat), bei Patienten, die aufgrund einer Hautverbrennung ein Hauttransplantat benötigen.
Allgemeine Informationen:
Diese Studie wird bei Personen im Alter von 1–17 Jahren durchgeführt, die aufgrund einer Hautverbrennung eine Hauttransplantation benötigen. Zwei verbrannte Hautbereiche werden ausgewählt und basierend auf einer zufälligen Verteilung wird das eine Areal mit denovoSkin™ und das andere mit Spalthaut des Patienten behandelt. Bei den Visiten nach der Transplantation werden beide Transplantate auf ihre Sicherheit und Wirksamkeit überprüft. Die gesamte Studie dauert etwa 12 Monate pro Patient und beinhaltet 10 Studienvisiten. Darüber hinaus finden jährliche Kontrollbesuche 2 und 3 Jahre nach der Transplantation statt.
Studie 3: denovoSkin™ für Rekonstruktionen bei Kindern und Erwachsenen
Titel:
Eine prospektive, intrapatient randomisierte, kontrollierte, multizentrische Phase-II-Studie zur Bewertung der Sicherheit und Wirksamkeit eines autologen biotechnologisch hergestellten dermo-epidermalen Hautersatzes (EHSG-KF) zur Behandlung von Vollhautdefekten bei Erwachsenen und Kindern im Vergleich zu autologen Spalthauttransplantaten (STSG).
Zusammenfassung:
Die Studie untersucht und vergleicht die Sicherheit und Wirksamkeit eines Hautersatzproduktes (denovoSkin™) aus patienteneigenen Zellen mit der aktuellen Standardmethode, d.h. der Transplantation eines dünnen autologen Hauttransplantats (STSG) bei Patienten, die aufgrund einer rekonstruktiven Operation eine Hauttransplantation benötigen, sei es durch die Entfernung einer Narbe, eines angeborenen Nävus, eines gutartigen Hauttumors oder durch eine Geschlechtsumwandlungsoperation.
Allgemeine Informationen:
Diese Studie wird bei Personen ab 1 Jahr durchgeführt, die aufgrund einer rekonstruktiven Operation eine Hauttransplantation benötigen.
Zwei betroffene Bereiche werden ausgewählt und basierend auf einer zufälligen Verteilung wird ein Areal mit denovoSkin™ und das andere mit Spalthaut des Patienten behandelt. Bei den Visiten nach der Transplantation werden beide Transplantate auf ihre Sicherheit und Wirksamkeit überprüft. Die gesamte Studie dauert etwa 12 Monate pro Patient und beinhaltet 10 Studienvisiten. Darüber hinaus finden jährliche Kontrollbesuche 2 und 3 Jahre nach der Transplantation statt.
Ein Unternehmen mit einer soliden Basis
CUTISS AG ist ein Spin-off der Universität Zürich (UZH) und wurde im März 2017 gegründet. An denovoSkin™ wurde aber schon vorher intensiv geforscht und in der Forschungsgruppe «Tissue Biology Research Unit» der Chirurgischen Klinik des Kinderspital Zürichs entwickelt. Die enge Zusammenarbeit zwischen Forschern und Chirurgen erwies sich als ideale Grundlage für die Entwicklung von denovoSkin™. Die Botschaft des klinischen Teams war von Anfang an klar: Mangel an Entnahmestellen sowie Narbenbildung haben oft keine zufriedenstellende Lösung. Die Mission für die Wissenschaftler war eine echte, innovative und effektive Alternative zur heutigen Standardmethode zu schaffen.
Die Entwicklung und Forschung an denovoSkin™ bekam durch die Finanzierung im Rahmen des FP7-EU-Programm entscheidenden Anschub: Die Phase I Studie zur Untersuchung der Sicherheit von denvoSkin konnte gestartet und 2016 erfolgreich abgeschlossen werden.
Seit Oktober 2016 unterstützt der Startup-Inkubator «Wyss Zurich» (www.wysszurich.uzh.ch/...) massgeblich unsere Arbeit nicht nur finanziell, sondern stellt zudem einen Reinraum zur Produktion von denovoSkin™ zur Verfügung.
Im Juli 2017, kurz nach der Gründung, investierte der neu gegründete UZH Life Science Fund, ein Joint Venture der UZH Foundation und des Novartis Venture Fund, eine Seed-Runde von 1 Million CHF, um die Automatisierung der Produktion von denovoSkin™ zu starten.
Im Mai 2018 schloss CUTISS AG eine Finanzierungsrunde (Serie A; Lead-Investor Giammaria Giuliani, Giuliani Pharma) mit 7.255.000 CHF (ca. 6,4 Mio. €) ab und erhielt zusätzlich die H2020-Förderung für kleinere und mittlere Unternehmungen (EU SME Instrument Grant). Mit dieser Finanzierung kann sich das Unternehmen weiterentwickeln und mit zusätzlichem Personal schneller und kompromissloser die Forschung und Automatisierung vorantreiben.
Das Team von CUTISS AG besteht momentan aus 18 Personen, die in den Bereichen Forschung und Entwicklung, Automatisierung, Produktion und klinische Studien tätig sind – ein sehr starkes und erfahrenes Team, das in engem Kontakt mit klinischen, regulatorischen und technischen Partnern steht.
CUTISS AG wurde in der Schweiz mit renommierten Preisen ausgezeichnet: Der beste Pitch am Schweizer Startup-Tag 2014, der beste Schweizer Businessplan 2015, der De Vigier-Preis 2017 sowie TOP5 Swiss Startup 2018 und TOP1 Swiss Biotech 2018.
Literatur und Links
- Marino D., Reichmann E., Meuli M. Skingineering Eur J Pediatr Surg. 2014 Jun;24(3):205-13. doi: 10.1055/s- 0034-1376315. Epub 2014 Jun 11
- Meuli M. et al. A Cultured Autologous Dermo-Epidermal Skin Substitute for Full Thickness Skin Defects:A Phase I, Open, Prospective Clinical Trial in Children. Plastic and Reconstructive Surgery, Plast Reconstr Surg. 2019 Jul;144(1):188-198. doi: 10.1097/PRS.0000000000005746
- www.cutiss.swiss/de
- www.wysszurich.ch
- www.clinicaltrials.gov - Study Identifiers: NCT03229564, NCT03227146, NCT03394612
Kontakt
CUTISS AG
Frau Dr.
Daniela Marino
Chief Executive Manager
c/o Wyss Zurich
Weinbergstrasse 35
8092 Zürich
Tel. +41 76 230 8046
eMail: daniela.marino@cutiss.swiss



